ph-Wert
Auszüge des Handbüchleins "Elektrische und wärmetechnische Messungen" der Firma Hartmann & Braun AG Frankfurt/Main, 2. Auflage, 1941 (H&B Druckschrift 481a / 20.000 / 6.41). Entsprechend UrhG §66 ist die Schutzfrist inzwischen abgelaufen (Stand von 2012), der Inhalt ist daher gemeinfrei. Das gescannte Büchlein findet sich im Abschnitt Schrifttum als PDF Datei.
Der pH-Wert ist ein Maß für die Anzahl der Wasserstoff-Ionen in einer Lösung bzw. für die Wasserstoff-Ionen-Konzentration. Die Wasserstoff - Ionen - Konzentration wird angegeben in Mol/Liter. Der praktisch in Frage kommende Konzentrationsbereich liegt zwischen 1 und 10^-14 Mol je Liter, umfaßt also ca. 14 Zehner-Potenzen. Da diese Zahlenwerte für den Gebrauch sehr unbequem und für die graphische Darstellung ungeeignet sind, wurde als Meßzahl der negative Exponent eingeführt. Dieser sogenannte „Wasserstoff-Exponent“ wird mit „pH“ bezeichnet.
Der gebräuchliche pH-Bereich erstreckt sich gemäß obiger Definition von 0 bis 14. Den pH-Wert 1 hat eine Lösung, die im Liter 10^-1, also 1/10 Mol Wasserstoff-Ionen enthält. pH 14 bedeutet eine Wasserstoff-Ionen-Konzentration von 10^-14 Mol/Liter.
Wasserstoff-Ionen sind die positiv geladenen Bestandteile des Wassers, das in geringem Maße in positive Wasserstoff-Ionen (H + ) und negative Hydroxyl- Ionen (OH-) zerfallen ist. Nach dem Massenwirkungsgesetz ist das Produkt aus H-Ionen und OH-Ionen-Konzentration für wässerige Lösungen konstant. Leitfähigkeits-Untersuchungen ergaben einen Wert von 10^-14. Ist die Wasser- stoff-Ionen-Konzentration einer Lösung z. B. 10^-4, so muß die Hydroxyl-Ionen- Konzentration 10^-10 sein.
Die Reaktion einer Lösung, d. h. ob sauer oder alkalisch, wird bestimmt durch die Anzahl der Wasserstoff- und Hydroxyl-Ionen. Bei gleicher Menge von H- und OH-Ionen in einer Lösung ist diese neutral. Der pH-Wert dieser Lösung ist 7. Wenn die Anzahl der H-Ionen überwiegt, so ist die Lösung sauer, bei Vorherrschen der OH-Ionen alkalisch. Eine Lösung ist umso sauerer, je mehr die Anzahl der H-Ionen die der OH-Ionen übertrifft und umso alkalischer, je mehr die OH-Ionen an Zahl überwiegen. Es ergibt sich also:
pH < 7: Die Lösung ist sauer;
pH — 7; Die Lösung ist neutral;
pH > 7: Die Lösung ist alkalisch.
Eine 1/10 normale Säure enthält 0,1 Mol Wasserstoff-Ionen im Liter, hat also den pH-Wert 1. Eine 1/10 normale Lauge hat entsprechend den pH-Wert 13. Durch den logarithmischen Charakter des pH-Wertes ist bedingt, daß die Konzentrationsänderung bei Änderung des pH-Wertes von 2 auf 1 eine zehnfache ist. Eine Lösung mit dem pH-Wert 1 ist dementsprechend zehnmal so sauer wie eine Lösung mit dem pH-Wert 2.
Bei der vorstehenden Definition wurde angenommen, daß die 1/10 normale Säure oder Lauge vollkommen in ihre Ionen zerfallen oder dissoziiert ist. Das trifft bei starken Säuren oder Laugen zu, nicht aber bei schwachen. Letztere enthalten die meisten Wasserstoff-Ionen in undissoziierter, d. h. unwirksamer Form. Es ist von großer Bedeutung, daß durch den pH-Wert nur die freien, also wirksamen Ionen erfaßt werden. Die insgesamt vorhandenen Ionen werden durch die Titration bestimmt. Der pH-Wert gibt also im Gegensatz zur Titration den wirksamen Säuregrad an (die sog. aktuelle Acidität), d. h. aus dem pH- Wert kann auf die Agressivität einer Säure oder Lauge geschlossen werden.
Beispiel: Bei Titration einer 1/10 normalen Salzsäure wird die gleiche Menge Natronlauge verbraucht wie bei einer 1/10 normalen Essigsäure. Die 1/10 normale Salzsäure ist sozusagen vollkommen dissoziiert, während die Essigsäure nur zu einem Fünfzigstel in ihre Ionen zerfallen ist. Die Anzahl der freien H-Ionen ist demnach bei der Salzsäure 50 mal so groß wie bei der Essigsäure oder die Säurewirkung der Salzsäure ist die 50fache der der Essigsäure oder die Salzsäure ist 50mal so stark wie die Essigsäure.
Pufferwirkung
Durch Verdünnen oder durch Zusatz von Säure oder Lauge wird der pH-Wert einer Flüssigkeit geändert. Die Auswirkung des Zusatzes ist verschieden und abhängig von der Art der Lösung. Flüssigkeiten, deren pH-Wert sich dabei leicht verändert, nennt man schwach gepuffert, solche, die nur weniger reagieren, sind stark gepuffert. Bei einer zehnfachen Verdünnung einer Säure müßte sich der pH-Wert um eine Einheit ändern. Bei Essigsäure, d. h. einer schwachen Säure ist die Änderung geringer, während Salzsäure, d. h. eine starke Säure ihren pH-Wert bei zehnfacher Verdünnung tatsächlich um eine Einheit ändert. Staike Säuren sind also geringer gepuffert als schwache. Destilliertes Wasser ist sehr schlecht gepuffert, so daß schon die Kohlensäure der Luft den pH-Wert nach der saueren Seite verschiebt.
Mischungen schwacher Säuren oder Laugen mit ihren Salzen sind gut gepuffert. Sie werden deshalb für Eichzwecke verwendet, da auch bei nicht allzu sorgfältigem Arbeiten ihr pH-Wert praktisch unverändert bleibt.
Messung des pH-Wertes
Für die Messung des pH-Wertes finden grundsätzlich zwei Verfahren Anwendung, nämlich das kolorimetrische und das elektro- metrische.
Die kolorimetrische Methode beruht darauf, daß Farb-Indikatoren, die der zu messenden Lösung zugesetzt oder die mit der Lösung befeuchtet werden, in Abhängigkeit vom pH-Wert die Farbtönung ändern.
Das elektrometrische Meßverfahren ist das genaueste und wird bei allen anderen Methoden zur Eichung herangezogen. Bei diesem Verfahren werden die elektrischen Wirkungen von in Lösung befindlichen Ionen auf Elektroden benutzt. Die Elektroden nehmen gegenüber der Flüssigkeit ein von der Ionen-Konzentration abhängiges Potential an.
Um das Potential der Elektrode gegenüber der Flüssigkeit messen zu können, wird eine zweite Elektrode, die von der Ionen- Konzentration nicht beeinflußt wird, in die Lösung eingetaucht (Bezugs-Elektrode). Die Potential-Differenz zwischen den beiden Elektroden steht in einem ganz bestimmten Verhältnis zu der Ionen- Konzentration.
Nach Nernst ist die Potential-Bildung wie folgt definiert: Tauchen zwei Metall-Elektroden in Lösungen ein, die Ionen des Metalls in verschiedenen Konzentrationen enthalten und die über einen Elektrolyten in leitender Verbindung stehen, so erhält man eine Konzentrationskette. Die EMK dieser Kette ist proportional der Differenz aus den Logarithmen der beiden Konzentrationen.
Eine mit gasförmigem Wasserstoff beladene Platin-Elektrode (PtH-Elektrode) verhält sich so, als ob sie aus einer metallischen Modifikation des Wasserstoffes bestünde. Eine Konzentrationskette, bestehend aus einer Platin-Wasserstoff-Elektrode und einer Bezugs-Elektrode liefert also eine Potential, welches abhängig ist von der Wasserstoff-Ionen-Konzentration oder dem pH-Wert.
Das Potential zwischen den Elektroden ändert sich bei einer Temperatur von 20°C um 58 mV, wenn sich der pH-Wert um eine Einheit ändert. Die Spannung der Elektrodenkette ist geradlinig vom pH-Wert abhängig.
Meß-Elektroden
Als Meß-Elektroden finden in der Hauptsache Verwendung:
1. Die Platin-Wasserstoff-Elektrode, welche sowohl für saure als auch alkalische Lösungen geeignet ist. Es ist die genaueste Laboratoriums-Elektrode. Ihre Handhabung ist mit einigen Schwierigkeiten verbunden, weil die Elektrode vor der Messung platiniert und während der Messung dauernd mit Wasserstoff umspült werden muß. Als Betriebs-Elektrode für Dauermessungen kommt ihr keine Bedeutung zu.
2. Die Chinhydron-Elektrode, welche vor allem zur Messung des pH-Wertes von sauren bis schwach alkalischen Lösungen benutzt wird (Anwendungsbereich 0-9 pH). Die Elektrode ist die im Laboratorium am meisten benutzte, da die Durchführung der Messung einfach und schnell vor sich geht. In die zu untersuchende Lösung wird Chinhydron eingebracht und zwar bis zur Sättigung. Dann wird eine Platin-Elektrode in die Lösung eingetaucht.
3. Die Antimon-Elektrode, welche eine metallische Elektrode ist und auch zur Messung von Lösungen dient, die bestimmte Elektrodengifte enthalten (Sulfide,Cyanide usw.), welche eine sichere Potential-Einstellung der Chinhydron- oder der Platinwasserstoff- Elektrode in Frage stellen. Die Handhabung ist sehr einfach, so daß sie trotz geringerer Meßgenauigkeit auch für Laboratoriumsmessungen häufig bevorzugt wird. Als Betriebs-Elektrode kommt ihr wegen der robusten Ausführungsmöglichkeit und der großen Unempfindlichkeit gegen Elektrodengifte höchste Bedeutung zu.
Für Betriebsmessungen werden die verschiedensten Formen angewandt. Bild 63 zeigt eine Antimon-Einbau- Elektrode, deren Aufbau äußerst einfach ist. Ein keramisches Rohr ist am unteren Ende mit Antimon ringförmig umgossen. Die Verbindung dieses Antimonringes mit den Anschlußklemmen in dem Elektrodenkopf ist durch einen eingelegten Platindraht hergestellt. Das Rohr dient gleichzeitig zur Aufnahme der Bezugs-Elektrode, die im Inneren untergebracht ist. Der Abschluß der Lösung im Inneren gegen die zu messende Flüssigkeit erfolgt durch einen mit einer Verschraubung gehaltenen Tonstift. Der ganze Elektrodenkörper ist in einen Leichtmetallkopf druckdicht eingesetzt. Die Elektrode ist geeignet für Drücke bis zu etwa 10 atü und Temperaturen bis 90°C. Sie kann selbstverständlich auch als Durchfluß-Elektrode ausgeführt werden.

4. Die Glaselektrode, welche als Universal-Elektrode bezeichnet werden kann. Bei Anwesenheit von Elektrodengiften, reduzierenden und oxydierenden Substanzen, Schwermetallen und Eiweißstoffen versagen die vorgenannten Elektroden in fast allen Fällen. Die Glaselektrode dagegen ist gegen diese schädlichen Einflüsse unempfindlich und praktisch für alle Lösungen beliebiger Zusammensetzung und Konzentration geeignet. Für das Laboratorium hat sie heute die größte Bedeutung, aber auch für Betriebsmessungen findet sie immer mehr Anwendung. Die Temperaturgrenze liegt im Dauerbetrieb durchweg bei etwa 45 ... 50°C. Für Betriebsmessungen werden sowohl Eintauch- als auch Durchfluß-Elektroden verwendet.
Eine Ausführung für Betriebsmessungen zeigt Bild 64. In einem Anschlußkopf sind die Glaselektrode und die Bezugselektrcde nebeneinander druckdicht eingebaut. Die Glaselektrode ist durch einen Schutzzylinder gegen mechanische Einflüsse geschützt. Als Durchflußelektrode wird das Ganze in ein Durchflußgefäß eingebaut.
Eine Ausführung für Verwendung im Laboratorium Bild 64 ist in Bild 66 dargestellt.
Als Bezugselektroden kommen hauptsächlich die gesättigte Kalo- mel-Elektrode und die Silber-Silberchlorid-Elektrode in Anwendung, die beide ebenfalls in den verschiedensten Formen Verwendung finden.

pH-Laboratoriumsmessung
Die Messung des Potentials der Elektrodenketten soll wegen der leichten Polarisierbarkeit und der damit verbundenen Meßfehler nach Möglichkeit stromlos erfolgen. Auf jeden Fall ist Vorbedingung für eine genaue Messung, daß der Elektrode kein oder nur sehr wenig Strom entnommen wird.
Im Laboratorium werden in der Hauptsache Messungen nach dem Kompensationsverfahren durchgeführt, in vereinzelten Fällen auch mit Röhren-Voltmetern. Bei beiden Messungen wird die Elektrode nicht belastet, so daß die oben gestellten Bedingungen erfüllt sind. Die Prinzipschaltung eines Kompensators, und zwar des H & B-Schleifdraht-Kompensators Pehavi, zeigt Bild 65.

Aus der Batterie B fließt bei der Stellung 1 des Umschalters U über den Regelwiderstand R und den Schleifdraht S ein Strom, der mit Hilfe des Strommessers G auf einen festgelegten Wert eingestellt wird. Zur Kompensation der bei X angelegten Spannung wird der Schalter U von 1 auf 2 umgelegt und am Schleifdraht die Stellung eingestellt, bei der der jetzt als Nullgerät verwendete Strommesser keinen Ausschlag mehr zeigt. Die Stellung des Schleifkontaktes gibt die Spannung der Elektrodenkette und damit den pH-Wert an. Mit dem Schleifkontakt ist eine Skala verbunden, welche zunächst eine Millivoltteilung besitzt, dann aber auch pH-Teilungen für die einzelnen Elektrodenketten. Durch Drehen einer Blende kann die im Augenblick gewünschte Skala sichtbar gemacht werden.
Das eingebaute Nullgerät hat eine so hohe Empfindlichkeit, daß auch das Potential von niederohmigen Glaselektroden direkt gemessen werden kann. Bild 66 zeigt das Pehavi in Verbindung mit einer Laboratoriums-Glaselektrode.
Sämtliche Elektrodenketten ändern ihr Potential mit der Temperatur der Lösung. Deshalb ist bei genauen Messungen unbedingt auf konstante Temperatur zu achten. Die gebräuchlichen pH- Kurven sind für eine Lösungstemperatur von 18° C angegeben. Falls die Temperatur im Augenblick der Messung höher oder niedriger ist, so muß der angezeigte pH-Wert berichtigt werden. Berichtigungstabellen oder Kurven stehen für jede Elektrodenkette zu Verfügung.

pH-Dauermessung
In den letzten Jahren hat die pH- Dauermessung (Anzeige, Registrierung
und Regelung) immer größere Bedeutung gewonnen und zwar für die verschiedensten Zweige der Industrie. Die hohe Bedeutung liegt darin, daß bei einer Anzahl chemischer Vorgänge der Reaktionsverlauf von der Wasserstoff-Ionen-Konzentration beeinflußt wird, oder daß sich während des Prozesses die Wasser- stoff-Ionen-Konzentration selbst verändert. An Hand der auf einem Schreibstreifen aufgezeichneten pH-Werte ist der Betriebsmann jederzeit in der Lage, auch nachträglich noch den Reaktionsverlauf eines Prozesses zu reproduzieren. Ebenso ist heute die Konstanthaltung des pH-Wertes auf einen bestimmten pH-Wert an den verschiedensten Stellen von größtem Interesse, so daß auch die pH-Regelung immer mehr Eingang in die Betriebe findet.
Bei den Meßgeräten für pH-Dauerkontrolle sind die gleichen Gesichtspunkte hinsichtlich Stromentnahme zu berücksichtigen wie bei den Laboratoriumsgeräten.
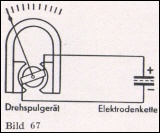
Für die direkte Messung des Potentials von Antimon-Elektroden wurden besonders empfindliche Meßweike entwickelt, die einen Stromverbrauch von nur wenigen Mikroampere haben. Die dabei auftretende geringe Belastung fälscht das Elektroden-Potential nicht. Der Anschluß der Elektrodenkette erfolgt genau wie der eines Thermoelementes, wie aus Bild 67 hervorgeht.
Falls sehr hohe Anforderungen an die Meßgenauigkeit gestellt werden, so wird häufig die sogenannte Halbpotentiometer- Schaltung angewandt. Bei dieser Schaltung (Bild 68) wird dem Elektroden-Potential eine andere Spannung entgegengeschaltet, so daß bei einem bestimmten pH-Wert kein Strom fließt. Dieser pH-Wert kann beliebig gewählt werden. Bei dem ausgewählten pH-Wert arbeitet das Meßgerät genau wie ein Kompensator, so daß also bei diesem pH-Wert die Elektrode überhaupt nicht belastet wird. Die abweichenden Werte werden dann wie bei der Schaltung nach Bild 67 nach der Größe des Zeigerausschlages gemessen.

Damit die hohe Meßgenauigkeit dieser Schaltung dauernd erhalten bleibt, muß von Zeit zu Zeit eine Kontrolle der Gegenspannung vorgenommen werden. Diese Kontrolle erfolgt in den meisten Fällen mit dem gleichen Meßgerät, indem nach entsprechender Umschaltung mittels eines vorgesehenen Einsteilwiderstandes die Spannung so einreguliert wii d, daß der Zeiger des Meßgerätes auf einen besonders gekennzeichneten Skalenpunkt einspielt. Bei noch höheren Genauigkeitsansprüchen wird die Kontrolle der Gegenspannung unter Verwendung eines Normalelements nach der Nullmethode durchgeführt. Eventuell kann auch für die Überwachung der Gegenspannung ein getrenntes Anzeigegerät herangezogen werden, was vor allem in Frage kommt, wenn Schreiber und Regler zusammen an eine Elektrodenkette angeschaltet werden.
Die Halbpotentiometer-Schaltung bietet noch einen weiteren Vorteil. Es besteht dabei die Möglichkeit, durch eine Zusatzeinrichtung die Temperatureinflüsse auf das Elektroden-Potential selbsttätig zu berichtigen, so daß die Anzeige oder Registrierung immer für eine bestimmte Temperatur richtig ist. Es ist hierfür der zusätzliche Einbau eines Widerstands-Thermometers in die Flüssigkeit erforderlich.
An selbsttätigen Kompensations-Meßgeräten für pH-Messungen, vor allem in Verbindung mit Glas-Elektroden, steht eine ganze Anzahl zur Verfügung. Ebenso werden Röhren-Voltmeter mit Erfolg angewandt.
Für pH-Messungen mit Glas-Elektroden ist der H&B-Fotozellen-Kompensator ((Näheres siehe Der Fotozellen-Kompensator "Potentiolux") mit einem besonders empfindlichen Nullgerät ausgerüstet worden, so daß Elektroden mit einem inneren Widerstand bis etwa 2 Megohm damit gemessen werden können.
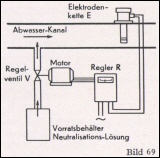
Der grundsätzliche Aufbau einer pH-Regelanlage entspricht dem einer Temperaturregelung. Sämtliche Einzelteile sind von der Temperaturregelung übernommen und für den Spezialverwendungszweck zugeschnitten worden. Die Prinzipschaltung einer derartigen pH-Regelanlage zeigt Bild 69.
Bei der Planung einer pH-Regelan- lage sind die örtlichen Betriebsverhältnisse von größter Wichtigkeit und müssen genau berücksichtigt werden, damit eine einwandfreie Konstanthaltung des pH-Wertes erreicht wird.
Zum Schluß sei bemerkt, daß die elektrometrische Meßmethode auch für die Bestimmung von Redox-Potentialen und für die potentiometiische Titration verwendet werden kann. Ebenso ist die Bestimmung anderer Ionen-Arten, z. B. Chlor-Ionen usw. sowohl im Laboratorium als auch im Betrieb von erheblicher Bedeutung.
Anwendungsgebiete der pH-Messung
Anwendungsgebiete der pH-Messung
Nachstehend soll nur auf einige Anwendungsgebiete aufmerksam gemacht werden. Die Aufstellung erhebt keinen Anspruch auf Vollständigkeit.
Braugewerbe: Überwachung des Brauwassers, der Maische und Würze.
Destillation und Kondensation: Überwachung des Kondensats auf Reinheit.
Filmindustrie: Überwachung des Waschwassers, der Bäder und Suspensionen.
Galvanotechnik: Überwachung der galvanischen Bäder, der Beizbäder, Neutralisation des Spülwassers und der Abwässer.
Gerbereien: Überwachung der Beizflüssigkeit.
Hüttenindustrie: Überwachung der Flotationsstrüben, Gasreinigung.
Kokereien: Gasreinigung, Ammoniumnitrat-Herstellung.
Kraftwerke: Überwachung des Kesselspeisewassers und der Wasseraufbereitung.
Papier-, Zellstoff-, Kunstseide-, Zellwolle- und Sprengstoffindustrie: Überwachung der Aufbereitung, der Bleich-, Seifen- und Waschbäder, der Sulfit-Kochung sowie der Abwässer auf Säuregehalt bzw. die Neutralisation derselben (letztere häufig in Verbindung mit Regelung).
Präparative Chemie: Herstellung von sauren, basischen oder neutralen Salzen.
Textilindustrie: Überwachung der Reinigungs-, Bleich- und Farbbäder, des Abwassers sowie des Kondensats von Heizschlangen.
Wasserwerke: Überwachung des Kalkzusatzes zum Trinkwasser zur Entsäuerung (in Verbindung mit Reglern).
Zuckerindustrie: Invertierung, Saturation, Vergärung der Melasse.
(C) 2012-2025 - Alle Rechte vorbehalten